Leaching Tembaga
1. Leaching
Leaching merupakan proses pengambilan logam berharga secara selektif dari bijih dengan leaching agents sehingga didapatkan suatu larutan kaya. Leaching juga bertujuan menaikan kadar dari bijih. Dalam melakukan leaching ada beberapa hal yang harus diperhatikan yaitu: [Habashi, 1982]
1. Leaching agents sebaiknya dapat diregenerasi agar bernilai ekonomis
2. Leaching agents harus murah dan mudah didapat
3. Material umpan harus bebas dari mineral-mineral lempung
4. Leaching agents bersifat tidak beracun, tidak mudah terbakar dan tidak korosif
5. Material umpan harus bersifat porous sehingga leaching agents mudah kontak dengan material umpan
Produksi tembaga 20% dilakukan secara hidrometalurgi, 80% dilakukan secara pirometalurgi dan elektrometalurgi. Tembaga di alam ditemukan dalam bentuk bijih yang bermacam-macam, dapat dilihat pada Tabel 1. sebagai berikut: [Davenport, 2002]
Tabel 1. Macam-macam bijih Tembaga
Teknik leaching yang bisa digunakan untuk leaching tembaga yaitu: [Habashi, 1982]
1. Insitu Leaching
Insitu leaching disebut juga sebagai leaching in places. Teknik leaching ini merupakan teknik yang paling tua dan sederhana serta diterapkan pada sisa-sisa penambangan. Jadi dapat dikatakan produk yang dihasilkan merupakan produk sampingan (by product). Waktu yang diperlukan sangat lama atau skala tahunan dan terutama diterapkan untuk bijih tembaga berkadar rendah. Teknik leaching ini dilakukan di Miami Copper Company (Arizona) untuk melarutkan tembaga dari bijih dengan kadar 0,15% tembaga dengan waktu 10-15 tahun.
Gambar 1. Skematik Insitu Leaching
2. Heap Leaching
Teknik heap leaching dilakukan pada tumpukan bijih berkadar rendah (tailing dari suatu proses pengolahan bijih) yang bagian bawahnya diberi lapisan kedap air (umumnya berupa aspal). Leaching agents disemprotkan dari atas tumpukan dan larutan kaya yang dihasilkan ditampung didalam kolam-kolam kecil dibagian bawah sebelah kanan dan kiri tumpukan bijih tersebut. Untuk lebih jelas nya dapat dilihat pada gambar 2. Waktu leaching-nya skala bulanan karena ada bantuan mikroorganisme yang aktif berperan untuk mempercepat proses pelarutan. Skala komersial heap leaching dilakukan di Rio Tinto, Spanyol untuk leaching tembaga dan seng dari bijih pirit (pyrite).
Gambar 2. Skematik Heap Leaching
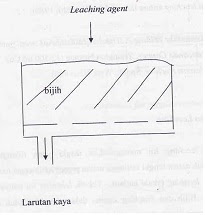
3. Percolation leaching
Teknik leaching ini menggunakan tangki sebagai tempat leaching dilakukan. Tangki dilengkapi dengan filter sehingga bijih tidak ikut lolos kebawah tangki. Gambar 3 menunjukkan skema tangki yang digunakan untuk melakukan teknik percolation. Pabrik yang menggunakan teknik percolation untuk pengolahan tembaga yaitu Anaconda Copper, Yerington Nevada (12.500 ton/hari).
Gambar 3. Skema Tangki Percolation Leaching
2. Leaching Agents yang Digunakan untuk Leaching Tembaga
Leaching agents yang biasa digunakan untuk leaching tembaga yaitu: [Habashi, 1982]
1. Asam Sulfat (H2SO4)
2. Amonia (NH4OH)
1. Leaching Tembaga dengan leaching agents Asam Sulfat (H2SO4)
Asam sulfat merupakan asam yang paling murah harganya dan tingkat korosivitas yang ditimbulkan lebih kecil serta dapat digunakan untuk melarutkan hampir semua jenis bijih daripada larutan asam lainnya. Asam sulfat umum digunakan dalam me-leach bijih tembaga oksida. Tembaga akan dapat diperoleh kembali dari larutan kaya hasil leaching setelah larutan kaya tersebut di elektrolisis (dapat dilihat pada gambar 4).
Gambar 4. Diagram Alir Pelarutan Leaching Tembaga dengan Menggunakan Asam Sulfat
Salah satu reaksi leaching tembaga menggunakan leaching agents asam sulfat sebagai berikut:
CuCO3.Cu(OH)2 + 2 H2SO4 → 2CuSO4+ 3H2O + CO2
2. Leaching Tembaga dengan Leaching Agents Amonia (NH4OH)
Amonia (NH4OH) adalah larutan NH3 dalam air, reaksinya dapat dituliskan sebagai berikut:
NH3 + H2O → NH4OH
Melarutnya logam tembaga dalam larutan amonia sudah diketahui sejak tahun 1858 yang ditemukan oleh Peligot. Larutan biru yang diperoleh dari hasil reaksi ini telah digunakan secara khusus untuk melarutkan selulosa dalam memproduksi cuprammoniun rayon, dan didalam indusri sintesis amoniak digunakan untuk menghilangkan karbon monoksida dari gas sintesa, yang jika tidak dapat meracuni katalis. Pelarutan tembaga tidak akan terjadi tanpa adanya udara, reaksinya dapat dituliskan sebagai berikut :
Cu + 4NH3 + ½ O2¬ + H2O → [ Cu (NH3)4 ]2+ + 2OH-
Adapun diagram alir leaching tembaga dengan menggunakan Amonia sebagai berikut:
Gambar 5. Diagram Alir Leaching Tembaga dengan Menggunakan Amonia
3. Mekanisme Pelarutan Bijih Tembaga
Adapun mekanisme pelarutan tembaga sebagai berikut: [Habashi, 1982]
Mekanisme auto-katalis
Pelarutan diasumsikan berlangsung pada 3 tahap:
a. Pembentukan Cupro-amine kompleks
2Cu + 4NH3 + ½ O2 + H2O 2 [ Cu(NH3)2]+ + 2OH-
Logam Cu bereaksi dengan amonia dan diinjeksikan oksigen menghasilkan larutan kaya Cupro-amine kompleks.
b. Oksidasi dari cupro-amine ke cupri-amine oleh oksigen
[Cu(NH3)2]+ + 2NH3 + ½ O2 + H2O [ Cu(NH3)4]2+ + 2OH-
Cupro-amine kompleks bereaksi dengan amonia dan oksigen yang masih tersisa menghasilkan cupri-amine.
c. Reduksi cupri-amine ke cupro oleh tembaga
[ Cu(NH3)4]2+ + Cu 2 [ Cu(NH3)2]+
cupri-amine bereksi dengan logam Cu yang awalnya belum ikut bereaksi menghasilkan Cupro-amine kompleks.
4. Kinetika Reaksi Leaching Tembaga
Laju pelarutan Leaching Tembaga dipengaruhi berbagai oleh ukuran partikel dari bijih, konsentrasi leaching agents serta leaching agents ini di bantu ole bakteri seingga laju pelautan tembaga lebih cepat.
1. Pengaruh Ukuran Partikel
Semakin halus ukuran partikel bijih, maka laju pelarutan tembaga lebih cepat jika dibandingkan dengan ukuran partikel yang lebih besar.
2. Konsentrasi Leaching Agents
Dapat dijelaskan melalui gambar berikut ini
Gambar 6. Pengaruh Konsentrasi Campuran Amonia Hidroksida dan Amonia Karbonat Terhadap Leaching Tembaga (250C, PO2 =6,8 atm)
Dari Gambar 1 merupakan hubungan konsentrasi Amonia terhadap laju pelarutan tembaga, dapat dilihat bahwa semakin besar konsentrasi Amonia maka laju dari pelarutan tembaga akan semakin cepat.
3. bantuan adanya bakteri:
Gambar 7. Leaching Tembaga Dari Chalcopyrite dengan dan tanpa bantuan bakteri
Dari gambar terlihat bahwa bakteri dapat mempercepat pelarutan tembaga. Dimana fungsi bakteri adalah sebagai katalis, yaitu dapat mempercepat laju pelarutan tembaga dimana tidak ikut bereaksi.
Secara Nenrst Boundary Layer, menggunakan NH4OH:
Amonia senyawa kimianya dituliskan dengan rumus NH4OH. Sedangkan Amoniak dituliskan dengan rumus NH3. Amonia adalah larutan NH3 dalam air, reaksinya dapat dituliskan sebagai berikut:
NH3 + H2O → NH4OH
Dari gambar dapat dijelaskan mula-mula NH3 berdifusi menuju fase padat, dimana NH3 berasal dari larutan NH4OH. Kemudian bereaksi dengan fase padat sebagai reaksi anodik, reaksinya sebagai berikut:
Reaksi Anodik,
Cu + 4NH3 → [ Cu (NH3)4 ]2+ +2e-
Selanjutnya O2 berdifusi menuju antarmuka dan terjadi reaksi dengan H2O (yang berasal dari NH4OH) sebagai reaksi katodik.
Reaksi Katodik,
H2O + ½ O2 + 2¬¬¬e- → 2OH-
Reaksi dari keduanya adalah sebagai berikut:
Reaksi Anodik: Cu + 4NH3 → [ Cu (NH3)4 ]2+ +2e-
Reaksi Katodik: H2O + ½ O2 + 2¬¬¬e- → 2OH-
_______________________________________________________________________________________________+
Cu + 4NH3 + H2O + ½ O2 → [ Cu (NH3)4 ]2+ + 2OH-
REFERENSI
Davenport, W. G. 2002. Extractive Metallurgy of Copper, Edisi 4, The Boulevard: Elsevier Science Ltd
Habashi, Fathi. 1970. Principles of Extractive Metallurgy, Vol.2. New York : Gordon and Breach, Science Publishers, Ltd
Langganan:
Posting Komentar (Atom)







Tidak ada komentar:
Posting Komentar